医薬品・医療機器等が患者さんに届けられるまで
新しい医薬品、医療機器や再生医療等製品等が開発され、患者さんの治療や診断に使われるようになるまでには、様々な動物や人を対象とした試験が行われ、その有効性と安全性について調べられます。これらの試験によって得られた結果は、最終的に厚生労働大臣から製造販売の承認を得るための資料となります。また、試験の結果は、学術論文の発表、販売された際の添付文書*といった形で社会に還元され、将来、多くの患者さんの治療や診断に役立つことになります。現在、私たちが使用している医薬品や医療機器は、すべて長い年月をかけて、このような試験を積み重ねることによって生み出されたものです。
*販売する際に添付することを義務付けられている文書。法令によって定められた項目が記載されている。
私たち名大病院の職員は、臨床試験にご協力くださる患者さんの期待を裏切らないよう、安全で質の高い治験の実施をこころがけております。
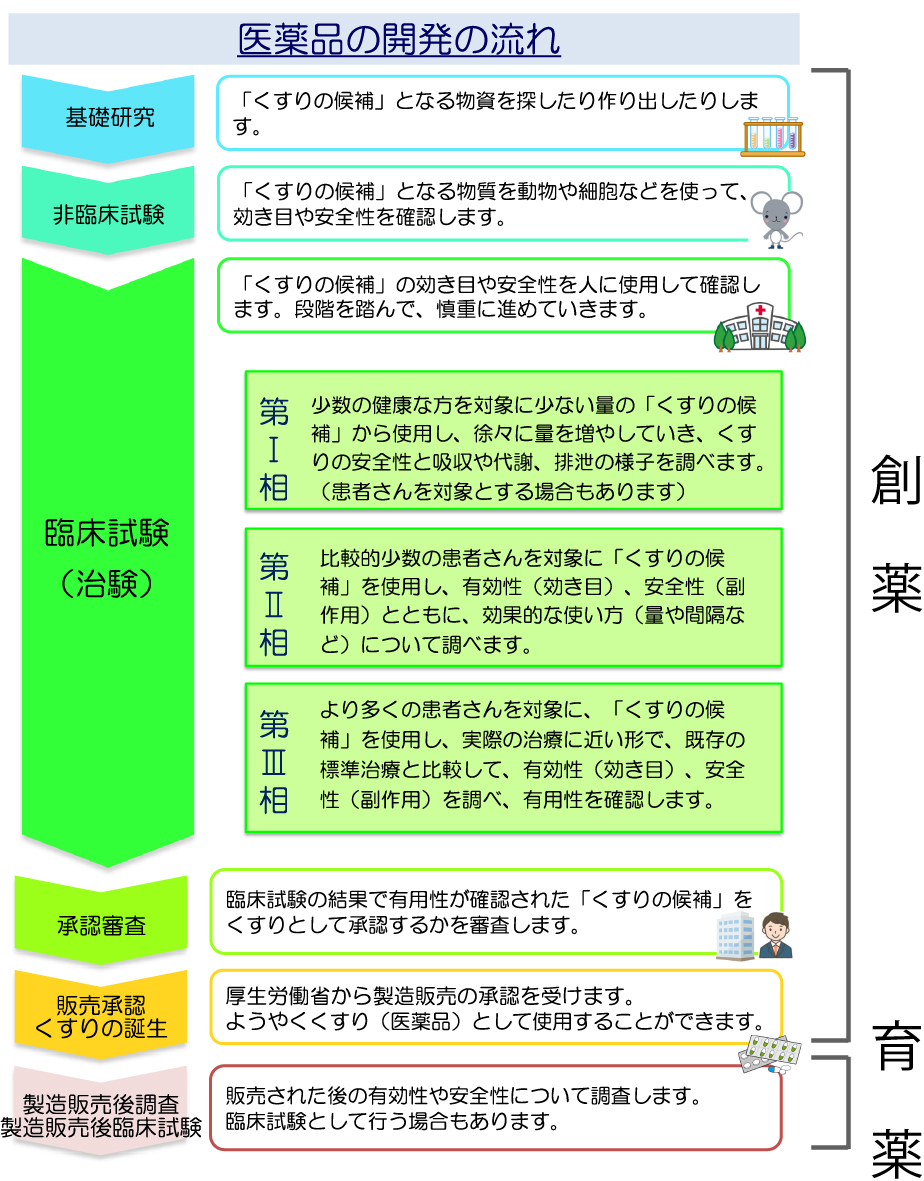
医薬品の開発の流れ
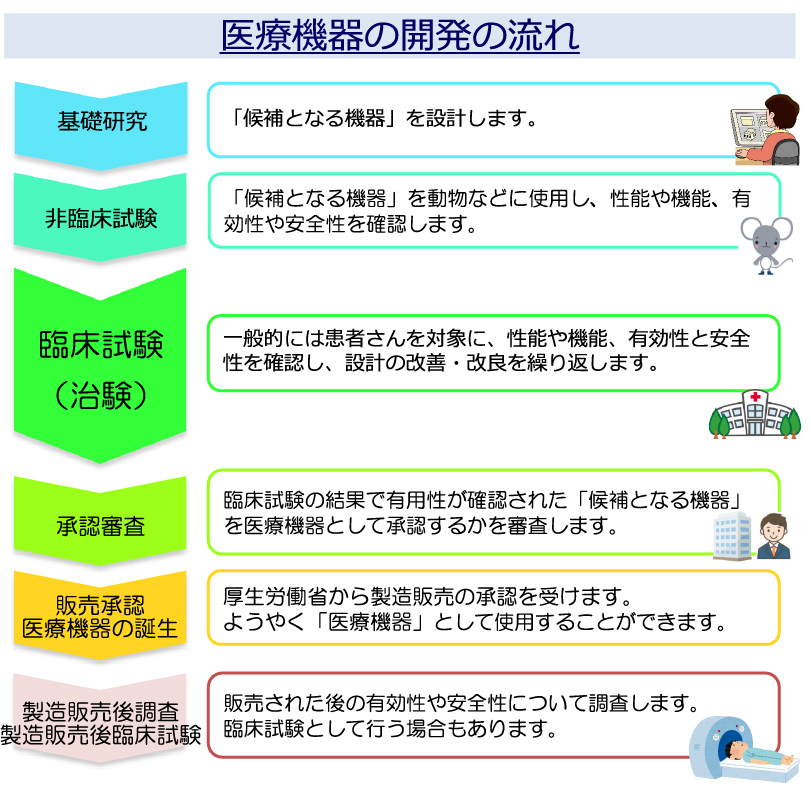
医療機器の開発の流れ
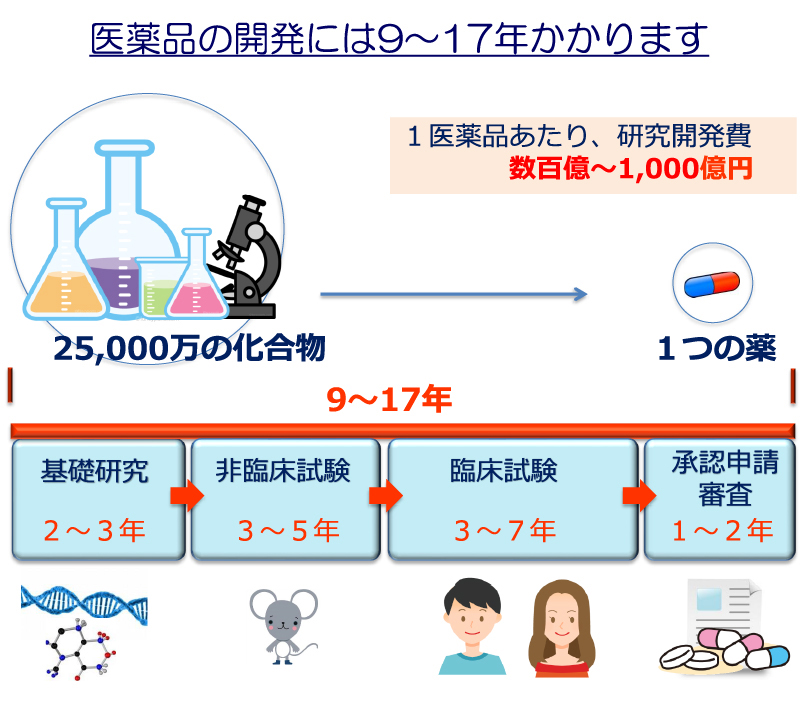
医薬品の開発にかかる年月と費用
治験に参加した場合のメリット・デメリット
メリット
・新しく開発しているくすりなどをいち早く試すことができます
・通常診療より詳しい検査や診察が行われます
・社会の役に立ち、次世代のためになります(創薬ボランティア)
デメリット
・必ずしも従来の治療より効き目があるとは限りませんし、プラセボ*や従来の治療を受ける**場合があります
・知られていない副作用が起きる可能性があります
・来院回数や検査が増えたり、普段使っているくすりが自由に使えない場合があります
*「プラセボ」とは
見た目や味は「くすりの候補」とまったく同じで、くすりの効き目のある成分が入っていないものです。くすりの成分を含んでいなくても、「くすりを使っている」という心理的効果から治療効果がでる場合があります(プラセボ効果と言います)。そのため、くすりの有効性や安全性を正しく判断するために、プラセボが用いられます。
**「従来の治療を受ける」とは
「くすりの候補」が有効で安全かどうかを見極めるために、一般的に「標準的な治療を受けるグループ」と「『くすりの候補』による治療を受けるグループ」に分け、有効性と安全性を比較します(標準的な治療が確立していない場合は、プラセボのグループと比較することもあります)。
このような試験を「比較試験」と言いますが、多くの場合、どちらのグループになるかは無作為な方法(くじを引くような方法)で割り当てられ、患者さんも担当医師も選ぶことができません。
また、どちらの治療を受けているか、患者さんも担当医師もわからない状態で実施することがあります。これを「二重盲検法」(にじゅうもうけんほう)と言いますが、臨床試験ではよく行われる方法です。
治験を正しく安全に進めるために
治験は「医薬品や医療機器等の候補」の有効性及び安全性を正しく評価するために、事前に厚生労働省に提出した治験の実施計画書に従って正しく進める必要があります。そしてなにより、参加される患者さんの人権や安全を守りながら実施することが重要です。
名大病院では、CRC(シーアールシー)(Clinical(クリニカル) Research(リサーチ) Coordinator(コーディネーター):臨床研究コーディネーター)が治験のお手伝いをしています。
CRCは、多くは看護師、薬剤師、臨床検査技師などの資格を持っており、患者さんが安心して治験に参加できるようサポートします。それ以外にも、医師の指示のもとで、治験が法律や規則、実施計画書に従って正しく行われるように、さまざまな業務を行っています。
CRCの役割

