治験開始から終了までの流れ
【医師主導治験】
9 治験開始
10 被験者の選定、インフォームド・コンセント、被験者登録
<被験者の選定>
人権保護の観点から、及び治験実施計画書に定められた選択・除外基準に基づき、被験者の健康状態、症状、年齢、性別、同意能力、治験責任医師等との依存関係、他の治験や臨床試験への参加の有無等を考慮の上、治験に参加を求めることの適否について慎重に検討します。
<インフォームド・コンセント>
治験責任(分担)医師は、被験者が治験に参加する前に、被験者候補に対して IRB 承認を得た最新の説明文書を用いて十分に説明し、治験への参加について自由意思による同意を文書により取得し、カルテに記録します。
<被験者登録>
治験実施計画書に定められた手順に従い、同意を取得した被験者の登録を行います。また、登録結果(登録の可否、被験者識別コードや登録番号など)をカルテに記録します。
11 他の主治医への連絡、治験参加カードの発行
<他の主治医への連絡>
被験者が他の診療科あるいは他院で治療を受けている場合、医薬品等との相互作用等による被験者の健康被害を防ぐために、被験者の同意のもとに、その医師に被験者の治験参加について知らせる必要があります。また、他院で治療中の場合は、被験者が既に受けている治療、投与されている薬剤等について他院の主治医から情報を得る必要があります。そのため、診療情報提供書等を用いて他院の主治医に連絡します。
<治験参加カードの発行>
被験者が治験中に他の医療機関を受診したり薬局で薬を購入したりする際に、治験参加中であり併用禁止薬があること等を知らせるための「治験参加カード」を被験者に発行し、被験者にこのカードの使用方法を指導します。
12 治験の実施(スクリーニング検査・評価の実施)
治験実施計画書に定められた検査および評価を、定められた方法や定められたスケジュールを守って実施します。治験薬投与を決定する前には、患者背景やスクリーニング検査の結果により、被験者の適格性(選択基準・除外基準)を確認します。
また、実施した行為(検査および評価の結果を含む)は、すべてカルテ等に記録します。
13 事務連絡①(被験者に対する費用の負担軽減に関する連絡)
<保険外併用療養費>
治験責任(分担)医師は担当CRCを通じて、治験開始時・終了時、治験薬以外に研究費等による費用の負担(変更を含む)が生じるタイミングで、医事課治験担当者に連絡します。医師主導治験では、診療にかかる費用の一部を研究費等で負担するなど被験者が支払う費用が一般診療とは異なる場合があるため、会計前に医事課に連絡する必要があります。
<被験者負担軽減費(支払う場合)>
被験者負担軽減費は、1か月分をまとめて、被験者の指定した銀行口座に、大学より振り込まれます。手続きは当センターが行います。被験者負担軽減費は治験参加に伴う交通費などの負担を軽減するためのものです。
14 治験薬投与
<治験薬オーダ>
治験薬のオーダは、電子カルテの薬剤オーダリングシステムで行います。治験薬のオーダは、治験責任(分担)医師のみ行うことができます。
<治験薬の適正な使用方法の説明・確認>
治験薬は、治験実施計画書に記載されている方法でのみ使用することができます。治験責任(分担)医師は、治験薬の正しい使用法を被験者に説明・指示するとともに、指示を守っているかを定期的に確認します。
<回収・返却>
被験者には未使用の治験薬や使用済みの空シート/バイアル等を医師または担当CRCに返却するよう指導します。担当CRCから治験薬管理室に返却された後に管理表とも照合し、記録を残します。治験薬の残薬や未使用分は当該治験の手順書に従って当センターにて対応します。
15 事務連絡②(臨床試験研究経費の請求)
症例組み入れ後、治験責任医師は担当CRCを通じて、すみやかに「症例発生報告書」を治験事務室に提出する場合があります。その後、治験事務室より、治験調整事務局に研究費を請求します。
なお、治験薬等管理の費用、CRC支援費用は、出来高払いになります。年度毎に「振替額通知書」により治験責任医師に請求します。不明な点があれば、治験責任医師より先端医療支援係に確認します。
16 症例報告書の作成
<原資料の特定>
治験開始前に、カルテ等の原資料に、元となる治験データ(原データ)が記録されるように、当センターは治験記録セットをテキストファイルで作成し、準備しています。治験開始後は、治験実施計画書に定められた検査や評価または情報収集(以下、治験データ)を定められたスケジュールに従って漏れなく実施し、実施したことはすべて、カルテ等の原資料にすみやかに記録します。
<症例報告書の作成>
症例報告書は、治験の評価日毎に、すみやかに作成します。CRCはカルテ等の原資料から症例報告書にデータを転記することができます。治験責任医師は、治験分担医師とCRCが作成した症例報告書の内容を点検・確認し、署名または記名押印および確認日を記載します。EDC(Electronic Data Capture:WEBを介した電子的な情報収集システム)を用いる治験も多くありますが、その場合は、ログインアカウントの管理が必要です。
また、症例報告書の内容と原資料の内容が矛盾する場合は、その理由を説明するための文書(矛盾記録)を作成します。
17 モニタリング・監査等の対応 → 申込手順等はこちら
治験責任(分担)医師は、モニタリング及び監査、またはIRB及び規制当局から調査の申し入れがあった場合、その調査を受け入れ、協力します。その際、求めに応じて、カルテ等の原資料及び治験関連書類等を準備し、閲覧に供します。これらの対応は、カルテ等の閲覧を伴いますので、当センター臨床研究支援部門(中央診療棟A地下1F)で行います。医学的判断を伴う問い合わせがある場合、治験責任(分担)医師は当センターにおいて対応しています。
18 (必要時に対応)
<各種変更時> → 必要書類等はこちら
治験責任医師(自ら治験を実施する者)は、治験期間を通じて、IRBの審査の対象となる治験実施計画書、説明文書・同意文書、治験分担医師・協力者リスト等を最新のものにしておく必要があるため、「治験に関する変更申請書」を用いて、適宜対応します。
<有害事象発生時>
有害事象が発生した場合は、直ちに被験者に適切な処置を行い、被験者に説明します。発生した有害事象の程度や治験薬との因果関係を判定し、被験者の継続参加の可否や、治験継続の可否を判断します。また被験者には治験への継続参加の意思を確認します。これらすべての経緯や判断についてカルテに記録します。
なお、発生した有害事象が重篤と判断された場合は、すみやかに下記<重篤な有害事象発生時>の対応をします。
<重篤な有害事象発生時> → 必要書類等はこちら
重篤な有害事象が発生した場合、当該治験の手順書に従い、適切に対応します。
治験責任医師は、当該重篤な有害事象について「重篤な有害事象に関する報告書」または「重篤な有害事象及び不具合に関する報告書」を作成し、直ちに病院長及び治験薬提供者に報告します。重篤な有害事象については、提出された報告書に基づき、直近のIRBにて治験継続の可否を審査します。治験責任(分担)医師に対してIRBでの説明を求める場合もあります。
なお、重篤な有害事象の発生により、あわせて以下の対応が必要になることもあります。
・被験者の安全性確保の観点から緊急の危険回避を目的に実施計画書から逸脱した場合:「緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書」の提出
・説明文書等の変更が必要と判断した場合:「治験に関する変更申請書」の提出
・当該治験全体の中止・中断が必要と判断した場合:「治験終了(中止・中断)報告書」の提出
<新たな安全性情報の入手時> → 必要書類等はこちら
他の実施施設で発生した重篤な有害事象に関する情報、海外症例情報、研究報告、措置報告、定期報告、その他(添付文書の改訂等)、治験薬の有効性や安全性等の新たな情報を得た場合、治験責任医師(自ら治験を実施する者)は、当該治験の手順書に従い、適切に対応します。
報告対応:
・入手した情報に対する見解を治験調整事務局に報告し、協議結果に基づき、以下の対応を行います。
・新たな安全性情報を病院長に報告する場合:「安全性情報等に関する報告書」の提出
・治験実施計画書の改訂や説明文書等を変更した場合:「治験に関する変更申請書」の提出
・当該治験全体を中止・中断した場合:「治験終了(中止・中断)報告書」の提出
これらの情報は病院長の指示のもと、治験の継続についてIRBで審査します。
被験者対応:
新たな安全性情報が被験者の同意に影響を及ぼすと考えられる場合、治験責任(分担)医師は、被験者に対してすみやかに情報提供し、治験への継続参加の可否について被験者の意思を確認し、経緯も含めてすべてカルテに記録します。治験の継続に同意されなかった場合は、治験を中止し、中止時の対応をします。また、治験の継続に同意された場合は、その後、IRB の承認を得た説明文書・同意文書(改訂版)を用いて被験者に再度説明を行い、文書で再同意を得て治験を継続します。
<被験者の緊急危険回避のための逸脱発生時> → 必要書類等はこちら
治験実施計画書からの逸脱(緊急の危険回避または医療上やむを得ない理由がある)が発生した場合、治験責任医師は、病院長及び治験調整事務局に直ちに「緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書」の提出により直近のIRBに報告します。
上記以外の治験実施計画書からの逸脱(検査・評価の実施漏れや実施日のずれ、治験薬の紛失など)については、すべてカルテに記録します。
また、治験責任医師は、逸脱の再発防止のため適切な措置(関係者への教育・指導、業務改善等)を講じます。
<治験の実施期間が1年を超える時> → 必要書類等はこちら
治験の実施期間が1年を超える場合、1年に1回以上、治験の継続の適否についてIRBで継続審査を受けます。当院では、継続審査は毎年3月または9月のIRBで審査されるため、治験責任医師は、「治験実施状況報告書」を作成し、担当CRCを通じて期日までに治験事務室に提出します。
<治験中止時> → 必要書類等はこちら
治験調整事務局から当該治験の中止・中断、あるいは治験薬の開発中止の連絡があった場合、治験責任医師(自ら治験を実施する者)は「開発の中止等に関する報告書」を病院長に提出するとともに、被験者に治験中止について十分説明を行い、十分な医療を提供します。
19 治験終了 → 必要書類等はこちら
当該治験が終了した場合は、治験責任医師は担当CRCを通じて「治験終了(中止・中断)報告書」を治験事務室に提出します。
20 終了後 → 必要書類等はこちら
<必須文書保管>
治験責任医師(自ら治験を実施する者)は、治験の実施に係わる必須文書等を、治験毎に決められた保管期間(治験実施計画書に規定された期間、覚書に記載された期間など)、適切に保存します。保管期間を延長する場合は、「開発の中止等に関する報告書」を病院長に提出します。
なお、治験終了後、治験責任医師の異動等により必須文書の管理が困難な場合は、すみやかに当センターに確認が必要です。
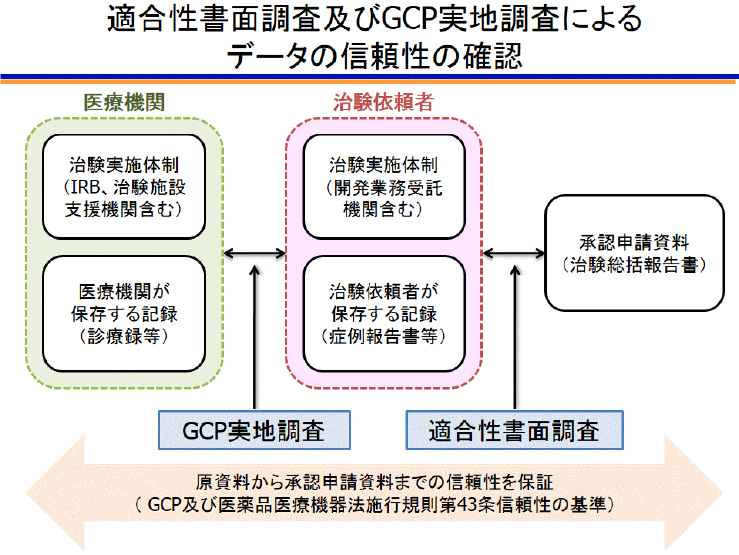
<GCP実地調査、査察>
治験薬提供者等が承認申請を行うと、当該治験の実施医療機関から2-4施設程度と治験調整事務局を対象に当局(PMDA等)による調査が行われます。実施医療機関の調査(GCP実地調査)では、症例報告書とカルテ等の原資料との整合性確認と、保管文書や当該治験関係者へのインタビュー等からGCPを遵守した治験が実施されたかの確認が行われるため、治験責任医師を含めた治験関係者で対応します。治験調整事務局の調査(適合性書面調査)では、症例報告書等と治験総括報告書との整合性確認と、保管文書(委受託契約、実施体制・運営等に係る資料)や当該治験関係者へのインタビュー等から承認申請資料の信頼性の確認が行われるため、治験調整医師を含めた治験調整事務局の関係者で対応します。
なお、国際共同治験では、海外の規制当局(FDA等)による査察の対象にもなり得ます。
PMDAウェブサイト
(https://www.pmda.go.jp/review-services/inspections/gcp/0004.html)より引用
