CRC業務内容について
先端医療・臨床研究支援センター 臨床研究支援部門 臨床研究推進室には、20名以上のCRC(SMO所属CRCを含む)が在籍し、企業治験・製造販売後臨床試験、医師主導治験、特定臨床研究などの協力者として幅広く活躍しております。
CRCは「名古屋大学医学部附属病院 クリニカル・リサーチ・コーディネーター標準業務手順書」に従い、責任医師の指示の下、主に以下の業務を行います。業務の遂行にあたっては、実施計画書や各種手順書の読込み、治験説明会やヒアリングへの参加、IRBへの陪席、スタートアップミーティングへの参加、担当モニターや治験責任医師との対話を通じて、治験の全体像の把握に努めます。
注:以下は、主に企業治験を例に説明しております。
医師主導治験では、自ら治験を実施する者が行う病院長・IRBへの手続き(申請・報告)についても支援しています。
治験責任医師が説明文書・同意文書を作成(改訂を含む)する際に、GCPで規定された項目が記載されているか、患者さんに分かりやすい記載になっているかなどに注視して内容を確認します。また、当院の説明文書・同意文書の作成見本(当センターホームページよりダウンロード可能)をもとに文書案を作成することも可能です。
その他、患者さんにお渡しする文書や資料(例:患者日誌、治験参加カード、被験者募集ポスターなど)についても、作成支援・内容確認を行いますので、ご相談ください。
●開始前に確認●
説明文書・同意文書案につきましては、担当CRCが確認の上、依頼者に返信します。その後、治験責任医師への最終確認を行います。
□ 治験参加カード(院内院外共通)
当院IRBで承認済の見本(当センターホームページよりダウンロード可能)があり、実施計画書から読み取れる内容(併用禁止薬や併用禁止療法等)を挿入するなどしてそのままの形式で使用する場合は治験毎のIRB審査は不要としています。記載内容の追加などでIRB審査を必要とする場合は、IRB審査資料になりますので、担当CRCに早めにご相談ください。
治験担当医師がリクルートした被験者候補について、治験の選択基準・除外基準とカルテや候補者から得た情報を照らし合わせ、被験者としての適格性の確認(スクリーニングの補助)をします。
なお、被験者候補のリストアップ(リクルート)につきましては、原則、対応しておりません。
治験担当医師による治験の説明から同意取得に至る一連の業務を支援します。
○ 最新の説明文書・同意文書の準備
IRBで承認された最新の説明文書・同意文書を準備し、内容を十分に理解しておきます。
○ 治験内容の補足説明
治験担当医師が説明文書を用いて患者さんに治験の説明を行う際に同席し、必要に応じて、スケジュール、参加期間、検査項目、費用等についてCRCより補助説明を行います。
CRCは、患者さんが治験の内容を十分に理解したうえで参加するかどうかの意思決定ができるように、わかりやすく説明することと治験に関する患者さんやご家族からの質問・疑問に適切に対応することを心がけて対応します。
○ 文書同意の確認
同意文書への記載が正しく行われるよう支援します。また、署名済み同意文書については適切に保管されるよう対応します。
患者さんに安心して治験に参加していただけるように、CRCは、来院時の面談、診察への同席、電話による状態確認や相談対応を行います。面談では、気になる症状の確認、有害事象の追跡、治験薬の服薬状況の確認、残薬や空容器の回収、併用薬剤の確認、他科他院受診の確認、バイタルサインの確認などを行います。必要に応じて診察に同席し、評価がスムーズに進むよう支援します。診察後は、服薬指導や次回受診時の案内(当日朝の服薬の有無、空腹が必要な検査、治験関連の持ち物)などを行います。また、他科受診の際は、必要に応じて診察に同席し、他科の医師に情報を提供します。
実施計画書で定められたスケジュールを遵守して治験を進められるように、CRCはスケジュールを管理します。
○ 登録開始時
登録期間内に、目標症例数の組入れが達成されるよう、治験責任医師と連絡を取って、候補患者さんの状況を確認しながら進めます。
○ 症例登録時
被験者毎のスケジュール表を用いて、年末年始、連休、休診日などに治験の来院日が重ならないように、開始時期を調整します。また、登録に必要な検査が決められた時期に実施できるように、関連部署と調整します。
○ 来院前
必要に応じて、次回来院予定日前に被験者に電話連絡を行い、来院予定日当日の注意事項を再確認します。
○ 各来院日
実施の手順が正しいか、検査・評価の実施項目に漏れが無いかなどを確認しながら進めます。
実施計画書において定められた項目のデータを適切かつ漏れなく収集できるように、治験記録用フォーム(テキストセット)を準備します。一般診療において収集しないデータや、収集手順や方法が異なる場合は、特に注意します。また、治験担当医師が有害事象や併用薬剤の使用状況等を経時的に確認・判断できるように支援します。
原データの記録にあたっては、帰属性、判読性、同時性、原本性、正確性、完全性を満たした信頼性の高い原資料の作成に努めます。
また、検査データがフィードバックされた場合は、当センターにおいてFAX受信やWEBダウンロードなどにより検査データを受領し、結果に対する治験担当医師の判断を仰ぎ、その後、適切に対応します。
●開始前に確認●
□国際電話、ECG回線など
<国際電話>
電話番号:052-744-1956 、FAX番号:052-744-2948
<ECG回線>
アナログ(トーン)回線です。0(ゼロ)発信は不要です。
<その他>
特殊な回線やデータ送信等が必要な場合は、早めにご相談ください。
□ IxRS
担当CRC 2名程度を登録していただきます。医師の登録については担当CRCにご相談ください。
□ 検査(画像検査含む)の実施、検査結果の提出が必要な場合
特殊な条件での撮像・提出やファントム撮影、健常人等での事前測定等が必要な場合は、早めにご相談ください。
CRCは被験者ケアと検査結果のすみやかな確認により、有害事象の早期発見に努めます。有害事象を疑う症状や検査結果を確認した際は、すみやかに治験担当医師に連絡し被験者への対応を依頼します。また、実施計画書や院内の規定に従い、適切に報告が行われるよう支援します。
新たな安全性に関する情報(他施設や海外で発生した副作用や重篤な有害事象)については、CRCも十分に理解した上で被験者の対応にあたります。
また、被験者への情報提供、説明文書の改訂、被験者への継続参加の意思確認、再同意などが適切に行われるよう支援します。
実施計画書を遵守して治験を進めていきますが、逸脱が発生した場合は、被験者の安全を確保した上で、逸脱の内容を記録し、実施計画書や院内の規定に従って報告できるよう支援します。また、治験責任医師と協力し逸脱の是正措置を講じるとともに、再発防止策(逸脱を未然に防ぐ方策やプロセス管理)を検討します。逸脱事項と再発防止策については関係者間で共有し、他の治験においても発生しないよう努めます。
被験者に対しては、治験参加中は「治験参加カ-ド」を携帯し、他院・他科受診する際や薬を購入する際は医師や薬剤師等の医療スタッフに治験の内容や併用禁止薬等を知らせるために「治験参加カ-ド」を提示するよう指導します。また、夜間や休日に当院の救急外来を受診する場合は治験参加中である旨を救急外来のスタッフに伝えるよう指導します。
なお、治験参加中は電子カルテ画面の上部には、治験マークが表示され、救急外来向けの情報が閲覧できるよう設定されています。
外注検体(集中測定用検体)については、当センタースタッフが対応(検体処理、保管、出検)します。CRCは手順書通りに適切に対応できるよう事前に手順書と検査キット等の資材の内容を確認し、採取日に備えます。
検査キットについては、使用時まで当センターで保管・管理し、使用する際に採血室などに搬送します。検体は当センター内の検体処理室にて処理し、検体提出時まで保管します。
●開始前に確認●
□ 手順書と検査キット等の資材の提供
担当CRCにご提供ください。
資材の搬入時期や搬入キット数、追加発注の手順について担当CRCとご相談ください。
□ 資材の送付先
〒466-8560 名古屋市昭和区鶴舞町65
名古屋大学医学部附属病院 先端医療開発部
先端医療・臨床研究支援センター
中央診療棟A 地下1階 「主担当CRC名、副担当CRC名(可能であれば)」 宛て
Tel:052-744-1956
Fax:052-744-2948
□ 検体の保管条件
室温に加え、冷蔵、凍結(-20℃以下、-70℃以下)も可能です。温度管理の詳細については、治験薬の温度管理についてのページをご確認ください。
□ 当センターに設置の遠心機とその性能
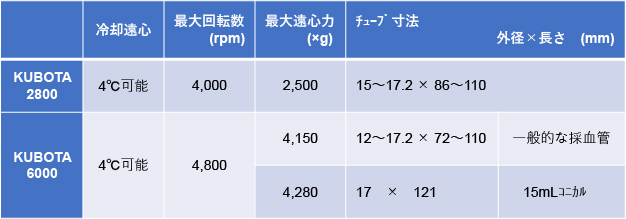
対応できない遠心条件がある、処理時の試薬等の使用、インキュベーター持込対応、血沈測定機器持込対応等がある場合は、早めにご相談ください。
なお、各遠心機は外部の校正を年に1回実施しています。
治験薬の投与や検査、評価、被験者ケアを行うにあたり、関連部門のスタッフが適切かつ安心して業務にあたることができるよう、事前に他部門と連絡を取り、打合せや説明を行います。特に一般診療と異なる手順や方法がある場合は、打合せや説明の際の同席、資料提供など依頼者に協力を仰くことがありますので、対応をお願いします。
症例報告書を正確に作成するため、あらかじめ依頼者から症例報告書の作成手引き等を入手し、作成上の注意事項を確認します。CRCとLDM(ローカルデータマネジャー)は、カルテ等の原資料から必要なデータを症例報告書に転記します。そのため、原資料に漏れなくデータが記録されるよう、治験担当医師とともに確認します。また、症例報告書を最終的に依頼者に提出する際は、記入漏れはないか、修正方法が適切か、作成者の署名(又は押印)・作成日の記入漏れがないかを確認します。
心電図波形や画像等のデータを提出する必要がある場合は、マスキングを確認後、当センターから送信(もしくは発送)対応します。
●開始前に確認●
□EDCアカウント
治験責任医師と、協力者として担当CRC、LDMから2~3名を登録していただきます。
治験分担医師の登録についてはご相談ください。
トレーニング等時間を要する場合は早めにご連絡ください。
直接閲覧を伴うモニタリング、監査、GCP調査の前に、日程調整と閲覧資料の準備、場所の確保、関係部署との調整を、治験事務室、IRB事務室と協力して行います。実施日当日は、依頼者等からの疑義照会やインタビューに対応し、治験担当医師との面会についても必要に応じて調整します。実地以外のモニタリング(メール等)にも対応します。
□ スタートアップミーティング
スタートアップミーティングは通常、依頼者、医師、CRCで行います。日程はCRCにご相談ください。
また、各種トレーニングの実施を兼ねる場合は、事前にご相談ください。
他部門のスタッフへ説明会が必要な場合は別途、開催します。
□ 提供を依頼する資材
提供資材はCRCが内容を確認(修正含む)しますので、すみやかに提供してください。
○ 各種手順書・マニュアル、症例報告書の見本等
○(既定の書式がある場合)被験者スクリーニング・登録名簿
○ 被験者毎のスケジュール表(電子媒体)
起点日を入れるとアロワンスを含め、来院日が自動計算される表が望ましい。
〇 評価日毎の実施項目チェックリスト(電子媒体)
〇 電子カルテ用入力ツール又はカルテシール(電子媒体)
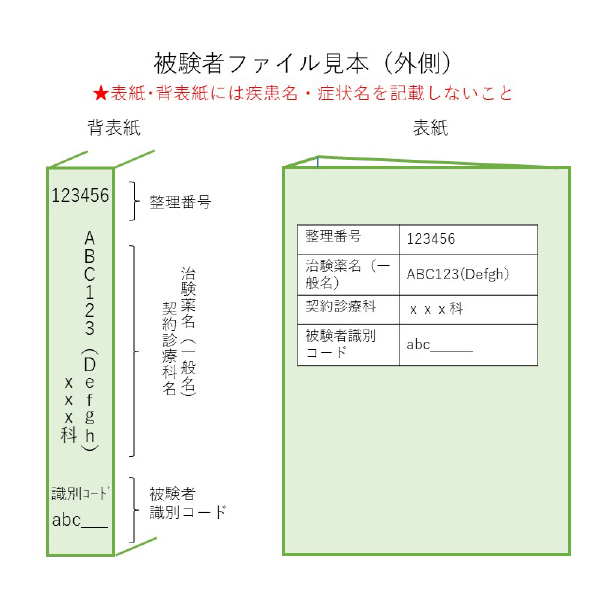
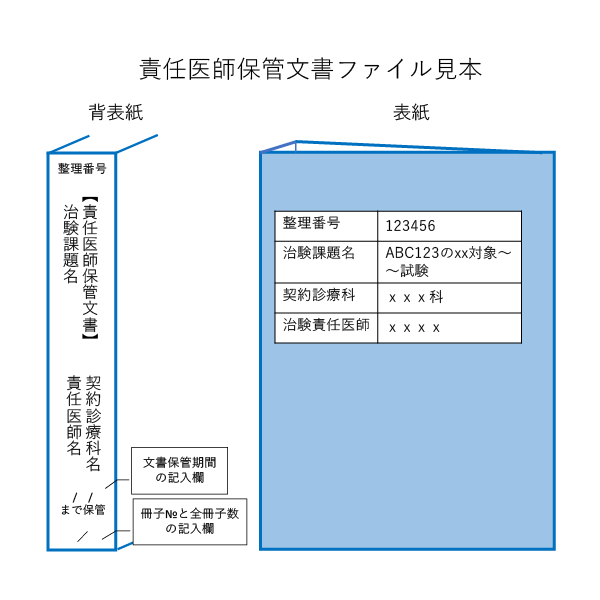
〇 被験者ファイル:契約症例数分+α
30穴のリングファイルで、クリアファイルやポケットファイルの収納用
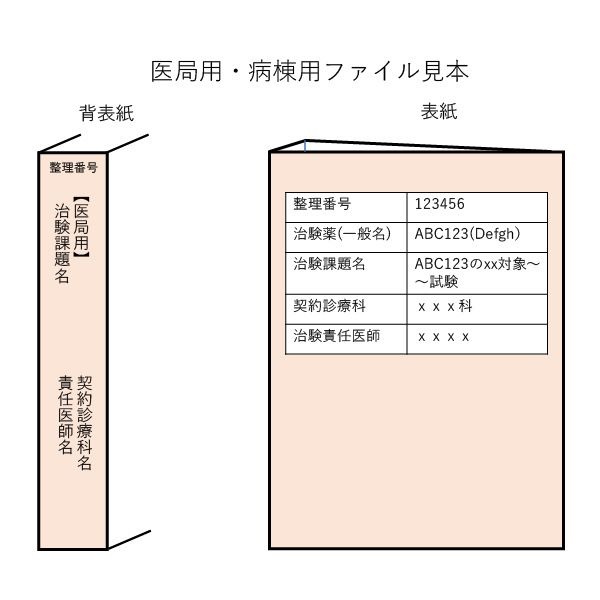
〇 医局設置用ファイル、(入院を伴う場合は)病棟設置用のファイル:各1部